Fondazione Porpora
“Fare agli altri quello che vorremmo che gli altri facessero a noi”
GIORNATA MONDIALE DELLE MALATTIE RARE
Author: admin4 Apr
GIORNATA MONDIALE DELLE MALATTIE RARE : 28 FEBBRAIO 2013.
L’ASSOCIAZIONE PER LA FONDAZIONE PORPORA ATTIVA E PROPOSITIVA ORGANIZZA LA ANNUALE MESSA PRESSO LA CHIESA DI SANTA MARIA MAGGIORE IN ROMA , ha celebrato Monsignor FORMENTI VITTORIO.
IN OCCASIONE DELLA GIORNATA PER LE MALATTIE RARE- 28-02-2013- L’ASSOCIAZIONE PER LA FONDAZIONE PORPORA HA ORGANIZZATO LA “MESSA ANNUALE PER LE MALATTIE RARE” La Giornata delle Malattie Rare è un evento annuale orientato all’aumento della conoscenza/consapevolezza sulle Malattie Rare coordinato da EURORDIS a livello internazionale e dalle Federazioni Nazionali dei pazienti a livello nazionale.
Nel 2012 63 Paesi ne hanno preso parte L’obiettivo generale della Giornata delle Malattie Rare è quello di
sensibilizzare l’opinione pubblica sulle malattie rare e il loro impatto sulla vita dei pazienti.
A livello comunitario, l’obiettivo è quello di aumentare la sensibilizzare sulle malattie rare tra le istituzioni dell’UE al fine di rendere le malattie rare una priorità di salute pubblica e nei programmi di ricerca e di budget
Il tema per il 2013 ci ricorda che guardare le malattie rare in una prospettiva internazionale è particolarmente importante, in termini di ricerca, politica sanitaria e per i milioni di pazienti e le loro famiglie di tutto il mondo che possono rompere il loro isolamento attraverso una vasta rete internazionale di solidarietà. L’ASSOCIAZIONE PER LA FONDAZIONE PORPORA VUOLE ESSERE UN ESEMPIO DI SOLIDARIETA’ ed il suo Presidente PORCELLUZZI FRANCESCA ha inteso stimolare anche la spiritualità cattolica , che ha partecipato numerosissima all’evento religioso.
- Commenti disabilitati su GIORNATA MONDIALE DELLE MALATTIE RARE
- Filed under: Articoli
CARNEVALE 2013 AL REPARTO DI ONCOLOGIA PEDIATRICA DELL’OSPEDALE GEMELLI DI ROMA
Author: admin21 Mar
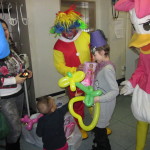
Il 12 Febbraio 2013 , in occasione delle ricorrenze carnascialesche, l’Associazione per la Fondazione Porpora ha organizzato un evento ludico con distribuzione di giocattoli presso il Reparto di Oncologia Pediatrica dell’ospedale Gemelli di Roma. Il Presidente Porcelluzzi Francesca , accompagnata da alcuni membri del direttivo e con l’ausilio del personale ospedaliero, si è recata in tutte le stanze ed incontrato tutti i piccoli degenti , consegnando loro i doni suddivisi per classi di età. I sorrisi dei piccoli , peraltro stimolati dalla presenza di un gruppo di figuranti nelle vesti dei più famosi personaggi DISNEY (ingaggiati dall’Associazione per l’occasione), hanno allietato la giornata anche ai genitori lì presenti.
Erano presenti anche personalità dello spettacolo e politiche. Il Sindaco di Roma ha fatto pervenire il suo saluto e l’augurio a continuare l’attività filantropica.
- Commenti disabilitati su CARNEVALE 2013 AL REPARTO DI ONCOLOGIA PEDIATRICA DELL’OSPEDALE GEMELLI DI ROMA
- Filed under: Articoli
DONAZIONE ALL’ASSOCIAZIONE “DIVENTO GRANDE” DI ROMA – (Assistenza Bambini Autistici)
Author: admin21 Mar
LA DONAZIONE DEL MESE FEBBRAIO 2013 : QUESTO MESE L’ASSOCIAZIONE PER LA FONDAZIONE PORPORA ED IL SUO PRESIDENTE FRANCESCA PORCELLUZZI HANNO DECISO DI EFFETTUARE UNA DONAZIONE ALL’ASSOCIAZIONE “DIVENTO GRANDE” DI ROMA – (Assistenza Bambini Autistici).
NELLA CORNICE DEL CIRCOLO UFFICIALI CARABINIERI TEVERE IN ROMA, IN OCCASIONE DEI FESTEGGIAMENTI CARNASCIALESCHI, OVE SI SONO RIUNITE LE FAMIGLIE DEI BAMBINI AUTISTICI FACENTI CAPO ALL’ASSOCIAZIONE “DIVENTO GRANDE” , SI E’ AVUTA LA PARTECIPAZIONE DEL PRESIDENTE DELL’ASSOCIAZIONE PER LA FONDAZIONE PORPORA – PORCELLUZZI FRANCESCA – CHE IN RICORRENZA DELLA CONSUETUDINARIA DONAZIONE MENSILE HA DECISO DI PROCEDERE AL RILASCIO DI UN CONTRIBUTO FINALIZZATO ALLA COPERTURA DELLE SPESE PER L’ACQUISTO DI MEDICINALI E STRUMENTI TERAPEUTICI. RINGRAZIAMENTI DAL PRESIDENTE DELLA ASSOCIAZIONE “DIVENTO GRANDE” CHE A NOME DELLE CIRCA 100 FAMIGLIE ADERENTI HA RIMARCATO L’ENCOMIABILE IMPEGNO DELLA PRESIDENTE PORCELLUZZI FRANCESCA E L’AUSPICIO A RITROVARE SOCIALMENTE EMULATO IL GESTO BENENFICO DELLA ASSOCIAZIONE PER LA FONDAZIONE PORPORA.
- Commenti disabilitati su DONAZIONE ALL’ASSOCIAZIONE “DIVENTO GRANDE” DI ROMA – (Assistenza Bambini Autistici)
- Filed under: Articoli
Le Malattie Rare
Author: admin8 Nov
Attualmente, sono state descritte nel mondo all’incirca 4-5.000 malattie rare (malattie che colpiscono una porzione di popolazione molto limitata). La maggior parte di esse manca di trattamenti appropriati per quattro motivi principali:
- i limiti nella conoscenza medica e scientifica relativa alla patogenesi della maggior parte delle malattie rare;
- un mercato limitato, alcune malattie interessano meno di poche centinaia di pazienti nel mondo;
- gli alti costi di ricerca e di produzione: il 50-80% delle malattie rare ha origine genetica. Per trattare tali malattie sono necessari prodotti di alta tecnologia (terapie geniche, terapie cellulari, proteine ricombinanti…) i cui costi di sviluppo aumentano proporzionalmente alla complessità della malattia; e
- l’impossibilità di brevettare determinati ingredienti (composti biotecnologici difficili da brevettare o molecole di dominio pubblico).
Tutti questi fattori conducono ai limitati investimenti delle industrie farmaceutiche e di biotecnologie e, di conseguenza, ai gravi ostacoli, in termini dei così necessari trattamenti efficaci.
Questa situazione sta sollevando una questione etica. A causa dei limiti finanziari, i pazienti si ritengono rifiutati dal sistema sanitario. Una parte significativa della popolazione non riceve i trattamenti che il progresso medico dovrebbe potere fornire. Un aumento di qualità e durata di vita per i pazienti affetti da malattie rare non è accessibile.
Un medicinale diventa un farmaco orfano se non è disponibile a causa di mancanza di interesse commerciale, malgrado possa essere potenzialmente utile in terapia. I farmaci orfani (farmaci destinati a trattare malattie rare) sono intrinsecamente non redditizi per l’insufficiente numero di utenti previsti rispetto ai costi di sviluppo e commercializzazione dei farmaci.
Lo scopo del presente lavoro è quello di fornire al Parlamento Europeo alternative politiche per costituire una efficiente Politica Europea per i Farmaci Orfani.
La disponibilità di farmaci orfani dipende dal verificarsi di situazioni favorevoli in 3 aree:
Bisogni dei pazienti
Strategie dei decisori
Struttura legale
Per permettere al Parlamento Europeo di discutere le alternative politiche con una piena conoscenza dei fatti, verranno discusse queste tre aree, principalmente effettuando una valutazione comparativa delle differenti situazioni inerenti i farmaci orfani negli Stati Uniti, in Giappone ed in Australia.
- Commenti disabilitati su Le Malattie Rare
- Filed under: Articoli
Cosa sono le malattie rare
Author: admin8 Nov
A partire dagli anni ’80 si è cominciato a trattare, sia in sede scientifica che programmatoria e di opinione pubblica, delle cosiddette malattie rare o malattie orfane. Le malattie rare sono condizioni morbose poco frequenti per definizione, ma anche poco conosciute, poco studiate e spesso mancanti di una terapia adeguata. Sono spesso chiamate “malattie orfane” perché poco appetibili alla ricerca sperimentale e clinica. Il razionale di raggruppare più forme morbose all’interno di uno stesso gruppo, con il determinante comune di avere una bassa prevalenza in popolazione, consiste nelle comuni problematiche clinico-assistenziali che le caratterizzano. La peculiarità delle malattie rare risiede nel fatto che esse richiedono un’assistenza specialistica e continuativa di dimensioni tali da non poter essere supportata senza un importante intervento pubblico. La rarità della malattia comporta un minor interesse della ricerca, eziologica e patogenetica, una maggiore difficoltà nel descrivere la storia naturale con le sue possibili varianti, nel progettare ricerche cliniche, un minor mercato capace di ammortizzare i costi di una ricerca farmacologica specifica ed infine una scarsa o scarsissima diffusione delle conoscenze comunque disponibili nella pratica corrente. In altri termini, la bassa prevalenza comporta un minor avanzamento delle conoscenze rispetto a quelle teoricamente possibili e soprattutto la non applicazione nella pratica corrente di quello che già si sa. I soggetti affetti si troverebbero pertanto in una situazione di doppio danno: il primo derivante dall’essere affetto da una patologia quasi sempre molto severa, il secondo dal non essere riconosciuti, diagnosticati e curati per quanto si potrebbe. Queste considerazioni hanno progressivamente portato a sostituire l’appellativo di “raro” con quello di “orfano”, inteso come privo di attenzione e risorse. Sotto le spinte di tali considerazioni si è iniziato a destinare risorse, sempre più rilevanti, alla ricerca e all’assistenza di tali patologie. Questo processo si è verificato a partire dagli Stati Uniti, per coinvolgere poi praticamente tutti i Paesi occidentali ed in seguito persino le politiche planetarie dell’Organizzazione Mondiale della Sanità, e molto recentemente anche l’Italia. Da queste politiche deriva la necessità di stimare con esattezza l’impatto in popolazione e nei servizi sanitari che il complesso delle malattie rare comporta. Tale impatto costituisce, infatti, il moltiplicatore di tutte le azioni o agevolazioni che eventualmente vengono riservate alle malattie rare.
Poiché le malattie rare non costituiscono un riconosciuto gruppo nosologico di malattie, ma un gruppo eterogeneo di affezioni caratterizzate solo dalla comune bassa prevalenza, è evidente che esse possono venire a comprendere un numero diversificato di malattie a seconda di quale sia il limite di occorrenza in popolazione considerato per dare l’attributo di raro ad una forma patologica.
Una definizione precisa di malattia rara non esiste. L’unica definizione ufficiale esistente e pertanto più frequentemente riportata è quella del Congresso USA che ha fissato in 200.000 abitanti il numero massimo degli affetti in tutti gli Stati Uniti da una malattia per essere considerata come rara, cioè circa un caso ogni 1.200 persone. Secondo le indicazioni del Programma d’azione Comunitario sulle malattie rare 1999-2003, vengono definite rare le malattie che hanno una prevalenza inferiore a 5 per 10.000 abitanti nell’insieme della popolazione comunitaria. Altri paesi hanno adottato altre definizioni. La legge giapponese, ad esempio, definisce rara una patologia che comprende meno di 50.000 casi (4/10.000) in Giappone. Ad oggi, in Italia non esiste una definizione univoca di malattia rara: diversi istituti od associazioni usano limiti definitori differenti. Viene definita patologia rara nel Piano Sanitario Nazionale una patologia o affezione con incidenza variabile da 1 su 20.000 a 1 su 200.000 abitanti delineando in questo modo una numerosità assoluta di 5.000 malattie, pari al 10% del totale delle malattie. L’Istituto di ricerca per le malattie rare “Mario Negri” di Bergamo riprende la definizione del Congresso americano. Nella letteratura medica italiana si trovano definizioni ancora più diversificate. Ad esempio, secondo alcuni Autori italiani si definiscono come “orfane” le condizioni morbose che colpiscono meno di 60.000 persone in Italia, pari circa allo 0,1% della popolazione complessiva. Le definizioni utilizzate da tutte queste fonti sono quasi sempre dissimili e di conseguenza le stime riportate sono altrettanto contrastanti.
L’Organizzazione Mondiale della Sanità considera almeno 5.000 le malattie e le sindromi che si possono considerare rare. Di queste la maggioranza sono malattie causate da un’anomalia genetica. Molte malattie sono rare in alcune aree geografiche o in alcune popolazioni e più frequenti in altre per ragioni legate a fattori genetici, alle condizioni ambientali, alla diffusione di agenti patogeni, alle abitudini di vita. Per la maggior parte delle malattie rare mancano dati precisi sulla loro frequenza, poiché per pochissime di loro esiste un sistema di notificazione dei casi a livello nazionale od internazionale.
Attualmente non esiste un’unica classificazione esauriente né a livello nazionale, né a livello europeo. Esistono diverse “liste” di malattie rare corrispondenti alla definizione di riferimento o all’interesse specifico dell’associazione o del gruppo di lavoro che l’ha prodotta. Anche se negli Stati Uniti esiste una definizione ufficiale di patologia rara, le classificazioni americane disponibili comprendono un numero di malattie che varia dalle 1.109 del National Organization for Rare Disorders (NORD) alle 2.117 dell’Office of Rare Diseases (ORD del National Institutes of Health). Il progetto francese Orphanet propone una lista di circa 5.000 nomi, sinonimi compresi, di patologie rare in ordine alfabetico. In Italia l’Istituto Superiore della Sanità su indicazione del Ministero della Sanità ha pubblicato un elenco di malattie rare esenti-ticket, suddiviso in categorie (es. malattie metaboliche, malattie genetiche, infettive).
Tutte queste classificazioni comprendono patologie assai dissimili per incidenza, per prognosi, per tipo di assistenza e per età.
Nelle classificazioni più ampie di malattie rare si ritrovano gruppi molto eterogenei di patologie:
- un primo gruppo rappresentato da malattie su base genetica o supposta tale, molto rare, con incidenza alla nascita inferiore a 1 su 10.000 nati,
- un secondo gruppo di malattie relativamente frequenti, come le leucemie, varie forme di tumori del bambino e dell’adulto, e patologie infettive come l’AIDS, la sifilide acquisita, ecc.,
- un terzo gruppo di patologie tipiche della senescenza, di diffusione sempre più ampia, come l’Alzheimer, il Parkinson, ecc.
Da quanto detto appare chiara la mancanza di una classificazione univoca ed esaustiva che consenta di suddividere tali patologie in categorie utili ai fini degli interventi sanitari e socio-assistenziali.
- Commenti disabilitati su Cosa sono le malattie rare
- Filed under: Articoli
Malattie rare: inquadramento e agevolazioni
Author: admin8 Nov
Nel maggio 2001 il Ministero della Sanità ha emanato due decreti che modificano il sistema di compartecipazione alla spesa sanitaria da parte delle persone affette da particolari patologie. Per comprendere le novità dobbiamo per fare un “salto indietro”.
Nel 1998 fu approvato un provvedimento (Decreto legislativo 29 aprile 1998, n. 124) che aveva come obiettivo la ridefinizione dell’intero sistema di partecipazione al costo delle prestazioni sanitarie e del regime delle esenzioni. Sarebbe stato introdotto il cosiddetto sanitometro, una specie di redditometro applicato alle prestazioni sanitarie agevolate anziché a quelle sociali. Come il redditometro, anche il sanitometro avrebbe tenuto conto della composizione del nucleo familiare e di altre condizioni sociali o di malattie. Dopo una sperimentazione diversificata, il sanitometro non è entrato in vigore.
Altre parti di quel decreto, tuttavia, sono entrate invece in applicate e sono quelle che prevedevano l’emanazione da parte del Ministero della Sanità di regolamenti che individuassero le condizioni di malattia cronica o invalidante e le condizioni di malattia rara.
Nel 1999 il Ministero della sanità ha indicato (Decreto 329 del 28 maggio 1999) l’elenco delle patologie croniche e invalidanti che danno diritto all’esenzione del ticket. Le patologie, o meglio le condizioni, sono 55 e per ognuna vengono indicate le prestazioni sanitarie, diagnostiche o di laboratorio che essendo correlate alla patologia, hanno diritto all’esenzione dal pagamento del ticket.
Il 21 maggio 2001, con il Decreto 296, il Ministero della Sanità ha aggiornato l’elenco delle malattie croniche e invalidanti e delle relative prestazioni.
La maggioranza delle ASL stanno adeguando, o hanno già provveduto a modificare i nuovi attestati di esenzione.
Il “regolamento di istituzione della rete nazionale delle malattie rare e di esenzione dalla partecipazione al costo delle relative prestazioni sanitarie” è stato invece approvato dal Decreto ministeriale n. 279 del 18 maggio 2001 (supplemento ordinario n. 180 alla GU n.160 del 12 luglio 2001).
Il Decreto istituisce a livello nazionale una rete finalizzata alla prevenzione, diagnosi e terapia delle malattie rare.
La rete è costituita dai presidi accreditati, che sono individuati tra quelli in possesso di documentata esperienza in attività o terapeutica specifica per le malattie o per i gruppi di malattie rare, nonché di idonea dotazione di strutture di supporto e di servizi complementari, ivi inclusi, per le malattie che lo richiedono, per l’emergenza e per la diagnostica biochimica e genetico-molecolare.
Tra questi presidi vengono individuati i centri di riferimento interregionali che svolgono funzione di sorveglianza, gestiscono l’attività di supporto e informazione ai cittadini, ai medici del Servizio Sanitario Nazionale, alle associazioni dei malati e dei loro familiari anche con momenti di formazione.
Presso l’Istituto Superiore della Sanità viene istituito il Registro nazionale delle malattie rare con compiti di programmazione, sorveglianza, archiviazione e analisi dei dati.
L’allegato al Decreto 279 propone un elenco di 47 gruppi patologie per un totale di 284 malattie rare. Ad ognuna di queste viene attribuito un codice univoco e indicato l’eventuale sinonimo con cui più frequentemente viene denominata la patologia (es. la malattia di Charcot Marie Tooth ha per sinonimo l’atrofia muscolare peroneale). Nell’elenco sono incluse anche le distrofie muscolari.
Ma quali sono le agevolazioni riconosciute alle persone affette da queste patologie? L’assistito, al quale venga formulato, da parte di uno specialista del Servizio Sanitario Nazionale, un sospetto diagnostico di malattia rara viene indirizzato dallo stesso medico presso uno dei presidi della rete in grado di garantire la diagnosi della specifica malattia.
Sono esentate dal ticket le prestazioni, erogate dal presidio della rete, finalizzate alla diagnosi, e, in caso di malattia ereditaria, anche gli esami genetici effettuati sui familiari. Gli oneri sono a carico della azienda unità sanitaria dell’assistito.
Inoltre gli assistiti affetti da malattie rare sono esenti dal ticket per le prestazioni sanitarie per il monitoraggio della malattia e per la prevenzione di eventuali aggravamenti.
- Commenti disabilitati su Malattie rare: inquadramento e agevolazioni
- Filed under: Articoli
MALATTIE RARE e I siti WEB: un potente motore di informazione e riferimento
Author: admin8 Nov
Molti siti WEB hanno per argomento le malattie rare e i farmaci “orfani”: i più rilevanti sono quello francese (Orphanet), quello statunitense, e, tra gli italiani, quelli del Ministero della Sanità, dell’Istituto Superiore di Sanità
In Italia esistono anche Associazioni che hanno la funzione di richiamare l’attenzione dell’opinione pubblica e delle autorità sul problema delle malattie rare.
Scopi delle organizzazioni che si occupano di malattie rare sono generalmente la raccolta e la distribuzione delle informazioni sulle malattie orfane agli interessati e ai medici, stimolare la ricerca, favorire lo sviluppo di una legislazione specifica, di assistenza, e disponibilità farmacologica oltre che favorire la consapevolezza della comunità attraverso l’uso dei media.
Il sito del Ministero della Sanità riguardante le malattie rare comprende:
- forum. E’ lo spazio dove poter offrire il proprio contributo, utilizzando l’apposito modulo con proposte ed interventi, da inviare direttamente al Ministero;
- documentazione. E’ la sintesi provvisoria del regolamento di istituzione della rete nazionale delle malattie rare esenti dalla partecipazione al costo;
- siti di interesse. Sono un breve elenco di alcuni siti, nazionali ed esteri, che si occupano di malattie rare.
The National Organization for Rare Disorder statunitense è un’istituzione formata da 140 organizzazioni senza fini di lucro che si occupa di malattie rare e disabilità, sostenuta da donazioni non governative. Tale organizzazione possiede una pagina Web contenente:
- un database delle malattie rare a consultazione gratuita con informazioni relative a più di 1400 patologie su ricerche nazionali e internazionali e sui gruppi di supporto (umbrella organization);
- un database dei farmaci orfani con dettagli sul loro meccanismo d’azione e sulla loro reperibilità.
L’Office of Rare Diseases statunitense, parte del National Institute of Health, fornisce informazioni su più di 2.117 patologie rare, includendo ricerche attuali, pubblicazioni scientifiche e gruppi di supporto.
Il sito ad esso relativo comprende:
- lista delle malattie e informazioni su di esse tramite i seguenti siti link:
- Healthfinder: il sito dove cercare informazioni provenienti dal governo americano, essendo parte del U.S. Department of Health and Human Services;
- NIH Health Information Index 2000: in tale sito è possibile formulare domande relative a patologie rare o avere contatti telefonici per informazioni sulla singola patologia;
- NIH Institutes, Centers and Offices: comprendente 25 Istituti e Centri facenti parte dei servizi pubblici del Dipartimento della Salute e dei Servizi Umani;
- Genes and Diseases: una descrizione delle basi genetiche fornite dal Centro Nazionale per l’informazione biotecnologica della biblioteca nazionale di medicina del NIH;
- PUBMED: archivio nazionale di medicina con libero accesso, contenente un vasto numero di pubblicazioni mediche e scientifiche riguardo le malattie rare;
- Online Mendelian Inheritance in Man (OMIM): un database dove è possibile consultare mappe geniche relative a malattie genetiche fondato da Johns Hopkins e facente parte del National Centre for Biotechnology Information;
- National Center for Education in Maternal and Child Health: fornisce informazioni sui servizi, pubblicazioni, conferenze riguardanti la salute dei bambini;
- Cancer Net of National Cancer Institute (NCI): contiene informazioni e un database delle malattie tumorali.
- List of Rare Diseases del Office of Rare Diseases: contiene una lista delle malattie rare.
- Glossary and Acronym: un piccolo vocabolario comprendente termini tecnici e definizioni;
- ricerche e trials clinici;
- organizzazioni umanitarie di supporto;
- informazioni riguardo spostamenti e alloggi per i pazienti;
- informazioni sulla genetica di tali malattie;
- progressi nelle ricerche e calendario dei simposi.
L’Orphanet Project è un progetto proposto nel 1995 dall’Orphan Drug Commission del Dipartimento della Salute Francese, fondato nel 1997 da due agenzie governative francesi: il D.G.S. (Direction Générale de la Santé) e l’INSERM (Istituto Nazionale della Salute e della Ricerca) avente come scopi:
- un database di informazioni su una particolare malattia, con una descrizione combinata dei segni clinici e biologici. Per ogni singola malattia vengono dati: definizione, progetti di ricerca, pratiche specialistiche, laboratori specialistici per la diagnosi, laboratori di ricerca, organizzazioni di pazienti, enti nazionali e internazionali, database simili o complementari, riferimenti bibliografici, trattamento, farmaci in uso, farmaci in via di sperimentazione. Tale database è a disposizione in lingua inglese e francese;
- elenco di malattie rare (circa 5.000). Per ciascuna è presente un piccolo riassunto delle principali caratteristiche cliniche, dei sinonimi o delle possibili inclusioni in altre patologie;
- forum di discussione, all’interno del quale è possibile ricevere risposte a quesiti sulle malattie rare
- Commenti disabilitati su MALATTIE RARE e I siti WEB: un potente motore di informazione e riferimento
- Filed under: Articoli
Cosa sono i farmaci orfani
Author: admin8 Nov
Un paese civile moderno non può non farsi carico di curare anche i suoi membri più deboli e lasciare loro la sensazione di essere abbandonati.
Negli Stati Uniti alla fine degli anni ’70 si è sviluppato un forte movimento di opinione, che voleva mettere al centro dell’attenzione dell’autorità e dell’opinione pubblica il problema dei così detti farmaci orfani e quindi la terapia delle malattie rare.
Questo termine era stato coniato da T.H. Althius; il farmaco Orfano è quel prodotto che potenzialmente è utile per trattare una malattia, ma non ha un mercato sufficiente a ripagare le spese del suo sviluppo, rimane perciò senza sponsor, ORFANO appunto.
Il problema legislativo nazionale: i farmaci orfani
In Italia la politica per lo sviluppo della ricerca scientifica è carente. Il D.L. n. 124 del 29 aprile 1998 decreta l’istituzione della rete e dell’esenzione delle malattie rare e promuove un’indagine conoscitiva dei Registri/Reclutamenti di malattie rare già esistenti a livello locale, regionale, interregionale e nazionale.
Rispetto alla peculiarità dei problemi connessi a tali patologie si prevede un’azione di coordinamento delle diverse iniziative in atto promuovendo quelle volte a garantire: diagnosi appropriata e tempestiva; facilitazioni dell’accesso a centri specialistici per programmi terapeutici; attività di prevenzione; sostegno alla ricerca scientifica, con particolare riferimento allo sviluppo di nuove terapie. Attualmente nel nostro paese non c’è una legislazione organica per le malattie rare e soprattutto una specifica per i farmaci orfani.
L’industria produttrice di farmaci in Italia dedica in media 8-12% del fatturato alle spese di ricerca complessiva. Considerando che le spese di ricerca e sviluppo per le malattie rare ammontino a circa 50 milioni di dollari spesi in dieci anni, 700 milioni di dollari investiti complessivamente dalle ditte farmaceutiche italiane per la ricerca nel 1987 sarebbero stati teoricamente sufficienti ad assicurare lo sviluppo di 14 farmaci con caratteristiche fortemente innovative nello stesso anno. Nel complesso delle aziende farmaceutiche italiane esiste un notevole patrimonio culturale e tecnologico, eppure nessuno potrebbe sostenere che negli ultimi 10 anni siano stati messi a punto in Italia 140 farmaci con caratteristiche fortemente innovative, ma neanche 111 o 47.
In verità non è più pensabile che si possa risolvere il problema a livello nazionale, ma occorre pensare ad una legge unica per la C.E. Nel 1993 a Londra fu fondato EMEA (agenzia europea per la valutazione dei prodotti medici). Nel 1995 entrò in vigore un nuovo sistema europeo per l’autorizzazione della registrazione dei medicinali. La necessità di una legge europea riguarda non solo il campo dello sviluppo e della ricerca, ma anche quello dell’informazione e della distribuzione dei costi.
Un farmaco costa oggi 250-500 mila dollari e in media dalla scoperta di un principio attivo alla sua commercializzazione possono passare da 10 a 14 anni. Quando viene messo in commercio, l’obiettivo è quello di recuperare le spese e quindi rendere molto e per molto tempo, ma per definizione gli acquirenti saranno pochi (farmaci orfani per patologie orfane o rare e/o per popolazioni con limitate risorse economiche). Molti ricercatori si occupano poco volentieri di malattie rare perché ci sono scarse probabilità di finanziamento e le cure rimangono allo stato embrionario. Nonostante siano rare, sono almeno 5.000 e costituiscono quindi un grosso peso per la Comunità Europea e un grosso gruppo di consumatori delle risorse della salute; ecco perché il loro trattamento può essere un buon investimento per la collettività.
Nell’ambito delle attività previste dalla “Ridefinizione del sistema di partecipazione al costo delle prestazioni sanitarie e del regime delle esenzioni” operata con il Decreto legislativo n.124 del 29 aprile 1998, il Consiglio Superiore di Sanità ha approvato uno schema di regolamento relativo alla “Istituzione della rete nazionale delle malattie rare e di esenzione dalla partecipazione al costo delle relative prestazioni sanitarie”.
Con il Decreto Legislativo del 18 maggio 2001, n. 279, il Ministero della Sanità adotta il “Regolamento di istituzione della rete nazionale delle malattie rare e di esenzione alla partecipazione al costo delle relative prestazioni sanitarie, ai sensi dell’articolo 5, comma 1, lettera b) del decreto legislativo 29 aprile 1998, n. 124”:
| Art. 5. (esenzione della partecipazione in relazione a particolari condizioni di malattia). – 1. Con distinti Regolamenti del Ministero della sanità da emanarsi ai sensi dell’art. 17, comma 3, della legge 23 agosto 1988, n.400, sono individuate rispettivamente: a) le condizione di malattie croniche o invalidanti; b) le malattie rare. le condizioni e malattie di cui alle lettere a) e b) danno diritto all’esenzione dalla partecipazione per le prestazioni di assistenza sanitaria indicate da medesimi regolamenti. Nell’individuare le condizioni di malattia, il ministro della sanità tiene conto della gravità clinica, del grado di invalidità, nonché della onerosità della quota di partecipazione derivante dal costo del relativo trattamento. |
Il suddetto Regolamento è teso a (art. 1):
- disciplinare “le modalità di esenzione dalla partecipazione al costo delle malattie rare per le correlate prestazioni di assistenza sanitaria incluse nei livelli essenziali di assistenza”, considerando ciascuna condizione morbosa e relative complicanze, le prestazioni di elevata frequenza, ed escludendo dall’esenzione le prestazioni caratterizzanti il percorso diagnostico di patologie esenti ad eccezione delle malattie rare;
- individuare “specifiche forme di tutela per i soggetti affetti”, sottolineando la necessità di garantire la disponibilità dei farmaci orfani e l’erogazione delle prestazioni assistenziali.
Per raggiungere gli scopi sopraindicati il Regolamento prevede l’istituzione di una Rete Nazionale per la prevenzione, la sorveglianza, la diagnosi e la terapia delle malattie rare (art. 2): tale Rete sarà costituita da presidi accreditati (preferibilmente ospedalieri) segnalati dalle regioni, tra cui il Ministro della sanità individuerà i Centri Interregionali di riferimento per le malattie rare. Sorveglianza e monitoraggio delle malattie rare sono compiti dei Centri interregionali di riferimento (art. 2), le informazioni e la documentazione da essi raccolta verranno centralizzate nel Registro Nazionale delle Malattie Rare istituito presso l’Istituto Superiore di Sanità (art. 3) (http://www.malattierare.iss.it), al fine di consentire una programmazione nazionale e regionale degli interventi, e regolamentando lo scambio ed il trasferimento di dati sensibili nel pieno rispetto delle leggi sulla privacy (art. 5).
Ai fini del riconoscimento del diritto all’esenzione il regolamento individua 284 codici di esenzione riferibili a malattie e/o gruppi di malattie, afferenti a 47 categorie di malattie (art. 4, allegato 1): per i soggetti riconosciuti affetti si prevede l’esenzione, presso i presidi della rete, per prestazioni, prescrivibili secondo criteri di efficacia ed appropriatezza (art. 7), riguardanti accertamento, trattamento ivi compresi i farmaci specifici, monitoraggio e prevenzione delle complicanze, per le malattie rare individuate dal regolamento stesso (art. 6).
Il problema legislativo internazionale dei farmaci orfani
Nel 1983 il parlamento americano approvò l’Orphan Drug Act, la prima legge in materia che aveva lo scopo di incentivare in vario modo la ricerca e lo sviluppo dei farmaci orfani.
I punti fondamentali di questa legge sono:
- la definizione epidemiologica di malattia rara come condizione che colpisce meno di 200.000 americani
- il market exclusivity, cioè il privilegio esclusivo di poter sfruttare il prodotto per sette anni senza competitività né per lo stesso farmaco orfano né per lo stesso uso orfano
- la Tax – credit ossia de-tassazione del 50% sui trial clinici umani
- la messa a disposizione di aiuti economici da parte di fonti governative per la realizzazione di studi clinici
- la ri-regolamentazione delle procedure di immissione in commercio e soprattutto la loro velocizzazione, senza peraltro venir meno delle garanzie di sicurezza del farmaco.
La legge oltre ad essere un successo scientifico, fu un successo economico. Infatti, per 17 anni precedenti a questa legge le industrie sponsorizzarono 34 farmaci, di cui 24 erano farmaci orfani sperimentali.
In sette anni di legge, di 42 farmaci sponsorizzati 39 erano farmaci orfani sperimentali.
Dal 1983 a adesso sono stati designati più di 900 farmaci e prodotti biologici come farmaci orfani, 743 saranno presto attivi e 182 hanno completato l’iter ricevendo l’approvazione della Food and Drug Administration.
Sorprendentemente, non sono state le grosse industrie americane a studiare e a produrre farmaci orfani, ma molte piccole e piccolissime imprese che si sono addirittura specializzate nella produzione di questi prodotti. L’interesse attorno ai farmaci orfani ha aperto un nuovo paradigma, quello dell’evidenza che nicchie di mercato possano, non solo essere d’interesse per l’industria, ma addirittura un elemento di strategia sul quale fondare i propri piani di sviluppo.
Nel 1993 il Giappone modifica il Pharmaceutical Affairs Law nel senso dell’Orphan Drug Act.
Dopo la legge giapponese, in Australia fu varato un nuovo programma per lo sviluppo dei farmaci orfani seguito da Food and Drug Administration. L’Orphan Drug Act servì da modello per gli altri stati: nonostante l’indiscusso contributo, la legge americana presenta numerose contraddizioni tanto che nel 1994 venne revisionata. La controversia sulla legge riguardava soprattutto due punti:
- market exclusivity
- disincentivazioni
Grazie all’esclusività del mercato per sette anni, l’impresa in questione aveva il completo monopolio sul farmaco, aumentando il suo profitto a scapito del prodotto. Con la revisione del 1994 l’esclusività di mercato fu portata a tre anni con la possibilità, fino ad allora esclusa, che due imprese potessero studiare sullo stesso farmaco. Le disincentivazioni erano costituite principalmente da:
- il piccolo mercato, che portava a spese di ritorno d’investimento minori rispetto ai costi d’investimento. Questo problema poteva essere risolto sfruttando il potenziale di alcuni farmaci di poter anche essere usati in malattie comuni.
- Un buco nei prodotti brevettati, alcuni dei quali, anche molto conosciuti, hanno fatto cadere il fatturato totale dal 39% al 29% (1960-1970).
- La responsabilità del prodotto. Maggiore è il rischio di effetti collaterali per farmaci orfani.
- Commenti disabilitati su Cosa sono i farmaci orfani
- Filed under: Articoli
Letture consigliate
Author: admin8 Nov
- Accanto ai disabili di Elisabetta Todeschini – Ed. Camilliane
- Caro scricciolo… di Elena Spaccamonti – Ed. Associazione Malattie Rare “Mauro Baschirotto”
- Il libro di Alice di Alice Sturiale – Ed. Polistampa Firenze
- La cicogna di Alessio di Giovanni Serra – Ed. Sonzogno
- La musicoterapia per bambini disabili di E.H.Boxill – Ed.Omega – Torino
- La speranza è un fiore di campo di Francesco Boni – Ed. Associazione Malattie Rare “Mauro Baschirotto”
- Ludovica di Marino Galzenati – Ed. Sperling Paperback
- Soldatini sparati di Barbara Cardamone – Ed. Mursia
- Un bambino speciale in famiglia di Diana Kimpton – Ed. Calderini
- Un figlio non può morire di Susanna Roccatagliata – Ed. Sperling & Kupfer
- Una vita impossibile di Paola Mazzuchi Cargiolli – Ed. Associazione Malattie Rare “Mauro Baschirotto”.
- Vestita di nuvole di Maria Simona Bellini – Ed. Sperling & Kupfer
- Commenti disabilitati su Letture consigliate
- Filed under: Articoli
Cari genitori..
Author: admin8 Nov
Sono la mamma di un bambino colpito da una malattia rara (la porpora anafilattoide) e mi rivolgo soprattutto a quei genitori che hanno bambini sani, che possono parlare, camminare, mangiare, respirare senza fatica e che pensano che tutti i bambini vivono con serenità la propria infanzia.
Mio figlio è nato nel 1998 e all’età di 6 anni gli è stata diagnosticata una malattia che concede l’illusione della speranza e forse anche qualcosa di più, ma non sempre è così, molti devono solo abituarsi ad una tragica realtà.
Chi ha fatto come me, la conoscenza dolorosa di una malattia rara sa che attorno a sé trova il vuoto: non esistono programmi assistenziali già confezionati per situazioni così complesse, i medici non trovano risposte ai perché di una mamma, la ricerca e le case farmaceutiche non impegnano tempo e denaro per casi così poco remunerativi.
Io, posso dirvi che mio figlio ama la vita, ama la sua mamma, il suo papà e la sorellina, ama tutti gli amici che in questo breve periodo della sua vita non gli hanno dato la possibilità di sentirsi solo.
L’Associazione per la Fondazione Porpora nasce proprio per non dare la possibilità ad altri bambini ed ai loro genitori di sentirsi soli.
Grazie a tutti coloro che ci aiuteranno a percorrere questo cammino.
Con affetto
Francesca
- Commenti disabilitati su Cari genitori..
- Filed under: Articoli